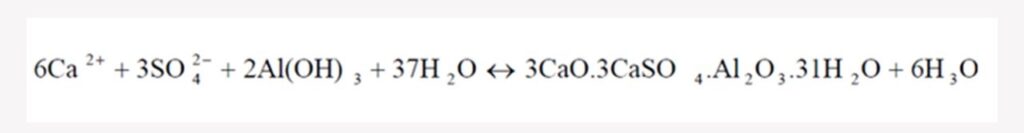Uno de los problemas típicos en las zonas altoandinas donde hay minería, es la eliminación de metales. A continuación compartiremos diversas técnicas de tratamiento de aguas en efluentes mineros y metalúrgicos.
Tratamiento con cal para remover metales pesados
Existen dos tipos de cal, la cal viva (óxido de calcio) y la cal muerta (hidróxido de calcio), ambos en apariencia son muy similares, pero difieren en el precio motivo por el cual se tiende a convertir la cal viva en apagada. La cal sea viva o apagada es muy insoluble, de ahí que se tenga que formar una lechada que es solución homogénea de coloides de estos óxidos e hidróxidos, no obstante, la solubilidad sigue siendo mínima (menos del 1%). Esta cal se prepara en tanques o sistemas de preparación de lechada de cal, en la cual se mezcla la cal con agua y de ahí obtiene lo que se conoce como lechada de cal.
Normalmente, los metales vienen mezclados con sulfatos disueltos en el agua ácida de minería. A este efluente se le agrega lechada de cal, donde el OH- reaccionará con el metal formando un hidróxido metálico.
Por otro lado, el exceso de calcio y sulfatos formarán sulfato de calcio (yeso), pero este al ser parcialmente soluble, no va a precipitar a menos que esté a altas concentraciones.
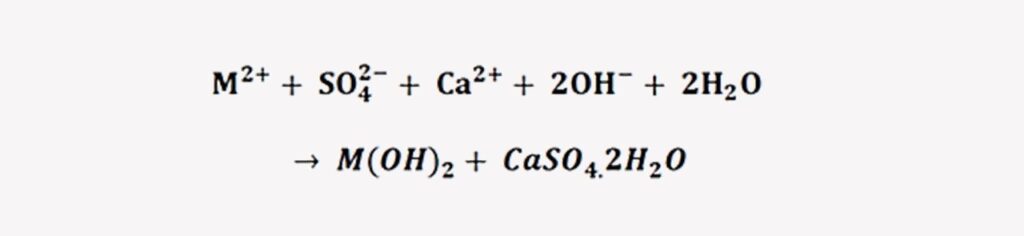
La desventaja de la precipitación con cal es que, al ser insoluble, se genera muchos lodos en el sistema.
Curva de Titulación
La curva de titulación sirve para estructurar la dosis o el pH óptimo. Esta curva será diferente para cada tipo de agua.
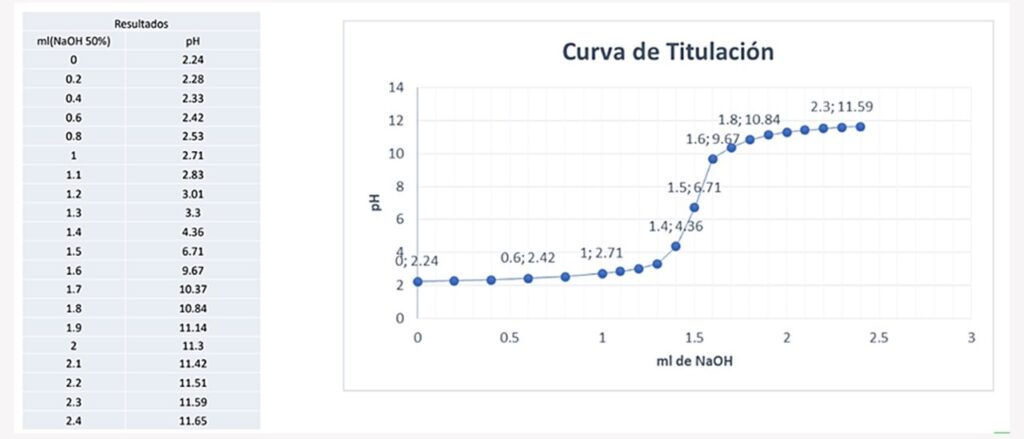
Para el siguiente ejemplo, al inicio la dosis es 0 y un pH de 2.24. Y algo peculiar es que al subir la dosis de 0 a 1ml el pH solo sube de 2.24 a 2.71, pero al subir de 1ml a 2ml el pH sube de 2.71 a 11.3.
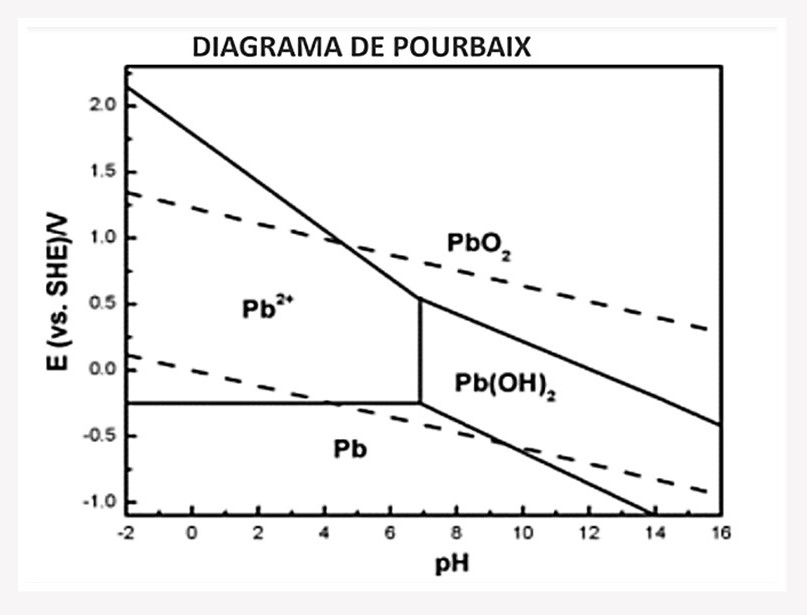
b. Diagrama de Pourbaix
Este diagrama indica la corrosión y agresividad de los metales, ya que está relacionado con el potencial óxido-reducción (ORP). Por ejemplo, un efluente de mina con plomo, puede tener un ORP muy bajo de 0.1 y un pH 3 y por tanto encontrarse en la etapa donde está como Pb+2, pero si incremento el pH a 8.5-9 se va a formar hidróxido de plomo (Pb(OH)3). Otro camino sería llevar el Pb+2 a óxido de plomo (PbO2), pero para ello tendría que aumentar el ORP. Ahora el ORP se puede aumentar mediante oxidante que es otra técnica para precipitar metales como se verá más adelante.
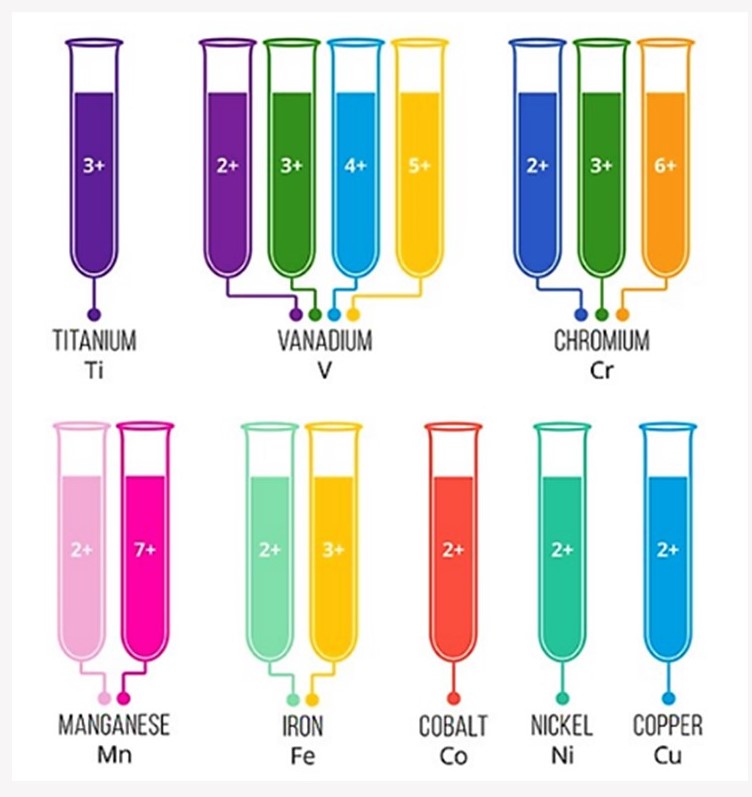
Coloración:
Cada metal va a generar una coloración dependiendo del metal y su estado de oxidación, como se muestra en la figura.
Precipitación con sulfuros
La precipitación viene dada por la reacción entre el metal y el sulfuro que termina formando un sulfuro metálico.
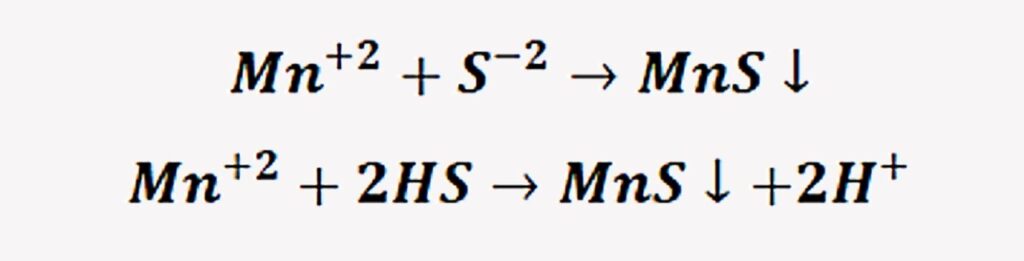
Consideraciones:
- Se requiere un sensor ORP porque el sulfuro al ser un agente reductor va a modificar el ORP.
- El mayor problema de este tipo de precipitación es que el sulfuro es tóxico y genera mal olor. No obstante, con los debidos controles de seguridad se puede trabajar.
- La mayor ventaja de esa técnica es que no tengo que aumentar mucho el pH para precipitar los metales, con pH de 7, 8 inclusive 6 puedo precipitar algunos metales. Esto implica un ahorro en costos en la base y generación de lodos que se puedan formar.
- Una de sus ventajas es que esta técnica genera menos lodos que la técnica con lechada de cal. Por lo tanto, implica un menor costo de disposición de lodos.
Precipitación con Oxidación
Esta técnica hace uso de oxidantes tales como peróxido de hidrógeno, ozono, cloro o cualquier agente oxidante para aumentar el ORP.
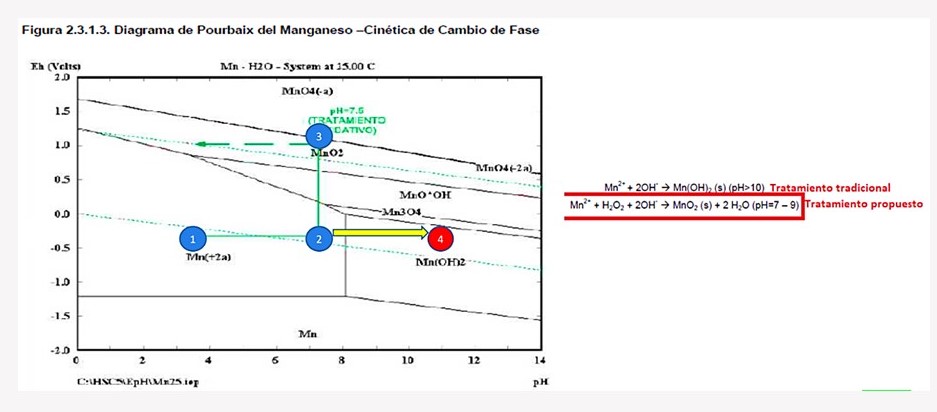
Para el caso del manganeso, si se precipitara mediante tratamiento convencional se agregaría un hidróxido y llevarlo hasta un pH de 11. Ahora, con ello obtendré un efluente del cual puedo remover el manganeso precipitado, pero de todos modos tendré un agua tratada alcalina cuyo pH tendré que disminuir mediante un ácido. Todo ello implica costos adicionales para subir y bajar el pH, lo cual genera más sales en el agua y más costos operativos.
No obstante, cuando se realiza la precipitación por oxidación el Mn(+2) se lleva hasta el punto 2 aumentado el pH de 7-8 y luego se oxida con peróxido de hidrógeno. Entonces en la reacción habrá M+2, peróxido y OH de modo que se forma un óxido de manganeso. Quiere decir que con este método se puede remover manganeso (Mn) y cualquier otro metal como un óxido metálico.
Eliminación de hierro y manganeso con arena verde
La arena verde (dióxido de manganeso) es un glauconítico natural capaz de reducir los iones mencionados a través de la oxidación y filtración. Una vez que los iones se oxidan y precipitan, se eliminan lavando los medios y una vez agotada la capacidad de oxidación los medios se pueden regenerar mediante solución de cloro o KMnO4.
Esta arena se coloca como material filtrante sobre un lecho y luego se filtra. No obstante, el objetivo de la arena verde no es filtrar sólidos suspendidos y remover turbidez, sino remover el hierro y manganeso principalmente.

Eliminación de Hierro y Manganeso con Cloro
En este tipo de precipitación también se utiliza un agente oxidante, en este caso cloro. Para el siguiente ejemplo se observa que el hierro (Fe+2) y el manganeso (Mn+2) son oxidados por el cloro a Fe+3 y Mn+4 respectivamente.
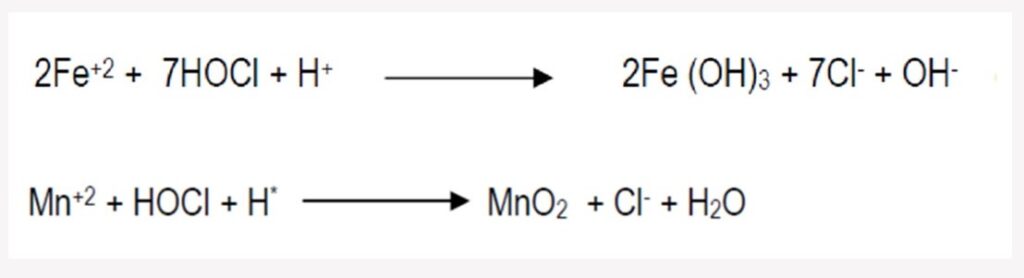
Teóricamente, por cada 1ppm de hierro (Fe) en el agua cruda a tratar se requiere 3.2ppm de cloro como HOCl para precipitarlo; y para el caso del manganeso (Mn) por cada ppm de manganeso a oxidar se requiere 1.9ppm de cloro libre. (Petrosevsky, 2003)
No obstante, esta es una relación teórica, y se requiere hacer el test de jarras y hacer la estimación ya que el cloro en términos experimentales reaccionará con amonio, materia orgánica, algas, bacterias y todo lo que haya presente en el agua, por ende la dosis puede ser mayor.
Eliminación de cromo VI y cromo III
El cromo tiene varios estados de oxidación y no todas sus formas son tóxicas. Está principalmente el cromo metálico (Cr), el Cr+3 que ya está disuelto que se utiliza como insumo para el curtido de pieles; y el Cr+6 que sí es tóxico y cancerígeno.
- El Cr+3 se elimina, subiendo el pH y precipitándolo como hidróxido.
- El Cr+6 en ese estado no precipita si se sube el pH, así que lo que se hace es reducirlo mediante un agente a Cr+3. Después, se lleva a un pH de 8.5 y se precipita como hidróxido (Cr(OH)3).
Los agentes reductores más comunes son el dióxido de azufre, metabisulfito sódico, bisulfito, donde el sulfuro es el agente reductor.
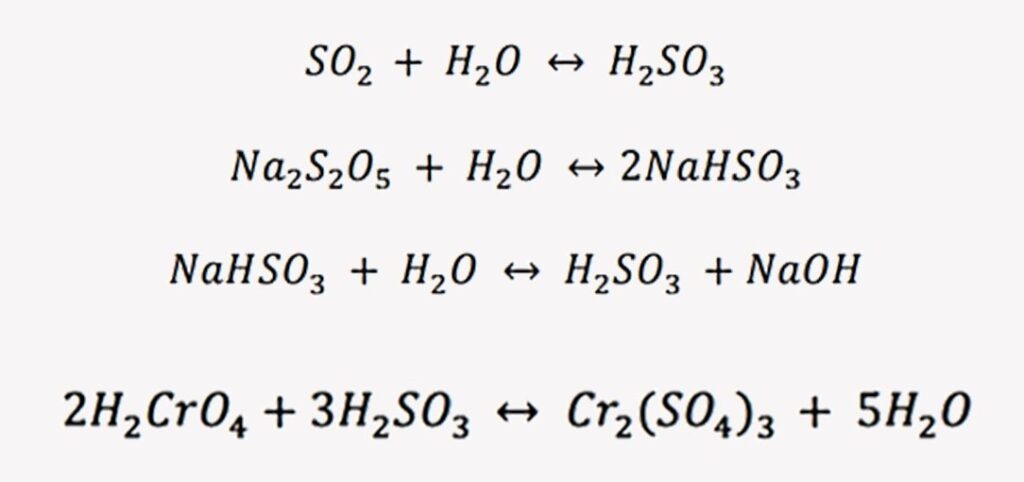

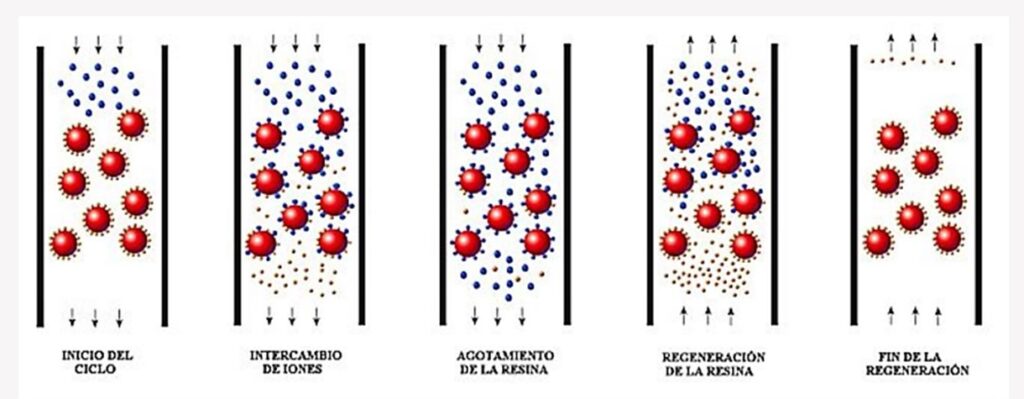
Remoción de metales por Intercambio Iónico
Esta técnica se lleva a cabo en unas resinas de intercambio iónico, que son material sintético sólidos e insolubles en agua, que se presentan en forma de esferas o perlas de 0.3 a 1.2 mm de tamaño efectivo, aunque también las hay en forma de polvo.
- Intercambio de cationes: Aquí, las resinas del intercambio de cationes emiten iones Hidrógeno (H+) u otros iones como intercambio por cationes impuros presentes en el agua.
- De ácidos fuertes: Ag+, Pb++, Hg++, Ca++, Cu++, Ni++, Cd++, Zn++, Fe++, Mg++, K+, Na+, H+
- De ácidos débiles: H+, Cu++, Ca++, Mg++, K+, Na+
- Intercambio de aniones: Aquí, las resinas de intercambio de Aniones despedirán iones de hydroxil (OH) u otros iones de cargas negativas en intercambio por los iones impuros que están presentes en el agua.
- De ácidos fuertes: CO=3, SIO=3, I-, HSO4-, NO-3, Br-, HSO-3, NO2-, Cl-, HCO3-, F-
- De ácidos débiles: SO=4, CRO=4, NO-3, I-, Br-, Cl-, F-
Remoción de sulfatos
Los iones sulfato también son un problema durante la precipitación de efluentes minero metalúrgicos y representa el mayor desafío técnico si lo comparamos con los otros iones metálicos.
De este modo, se debe tener en cuenta:
- Cuando las concentraciones son superiores a la de la solubilidad del CaSO4, se suele utilizar el reactivo Ca(OH)2.
- Otra alternativa para precipitarlos es mediante sales tales como: sales de bario (BaCl2), sales de plomo (PbNO3) y sales de aluminio más sales de calcio en tasas estequiometrias fijas y a un pH>10.5.